CALB inmovilizado
CALB se inmoviliza por adsorción física en la resina altamente hidrófoba que es un polímero macroporoso de estireno/metacrilato.El CALB inmovilizado es apto para aplicaciones en disolventes orgánicos y sistemas sin disolventes, y puede reciclarse y reutilizarse durante mucho tiempo en condiciones adecuadas.
Código de producto: SZ-CALB- IMMO100A, SZ-CALB- IMMO100B.
★Mayor actividad, mayor selectividad quiral y mayor estabilidad.
★Mejor desempeño en las fases no acuosas.
★Retire fácilmente del sistema de reacción, termine rápidamente las reacciones y evite los residuos de proteínas en el producto.
★Se puede reciclar y reutilizar para reducir el costo.
| Actividad | ≥10000 PLU/g |
| rango de pH para la reacción | 5-9 |
| Rango de temperatura para la reacción | 10-60 ℃ |
| Apariencia | CALB-IMMO100-A: Sólido de amarillo claro a marrón CALB-IMMO100-B: sólido de color blanco a marrón claro |
| Tamaño de partícula | 300-500 μm |
| Pérdida por secado a 105 ℃ | 0,5%-3,0% |
| Resina para inmovilización | Polímero macroporoso de estireno/metacrilato |
| Disolvente de reacción | Agua, disolvente orgánico, etc., o sin disolvente.Para la reacción en algunos solventes orgánicos, se puede agregar un 3% de agua para mejorar el efecto de la reacción. |
| Tamaño de partícula | CALB-IMMO100-A: 200-800 μm CALB-IMMO100-B: 400-1200 μm |
Definición de unidad: 1 unidad corresponde a la síntesis de 1 μmol por minuto de laurato de propilo a partir de ácido láurico y 1-propanol a 60 ℃.Los CALB-IMMP100-A y CALB-IMMO100-B anteriores corresponden a portadores inmovilizados con diferentes tamaños de partículas.
1. Tipo de reactor
La enzima inmovilizada es aplicable tanto al reactor por lotes de caldera como al reactor de flujo continuo de lecho fijo.Debe tenerse en cuenta para evitar el aplastamiento debido a una fuerza externa durante la alimentación o el llenado.
2. pH, temperatura y disolvente de la reacción
La enzima inmovilizada debe agregarse al final, después de agregar y disolver otros materiales y ajustar el pH.
Si el consumo de sustrato o la formación de producto conducen a un cambio de pH durante la reacción, se debe agregar suficiente tampón al sistema de reacción, o se debe monitorear y ajustar el pH durante la reacción.
Dentro del rango de tolerancia de temperatura de CALB (por debajo de 60 ℃), la tasa de conversión aumentó con el aumento de la temperatura.En el uso práctico, la temperatura de reacción debe seleccionarse de acuerdo con la estabilidad del sustrato o producto.
Generalmente, la reacción de hidrólisis del éster es adecuada en el sistema de fase acuosa, mientras que la reacción de síntesis del éster es adecuada en el sistema de fase orgánica.El solvente orgánico puede ser etanol, tetrahidrofurano, n-hexano, n-heptano y tolueno, o un solvente mixto adecuado.Para la reacción en algunos disolventes orgánicos, se puede añadir un 3 % de agua para mejorar el efecto de la reacción.
3. Reutilización y vida útil de CALB
En las condiciones de reacción adecuadas, CALB se puede recuperar y reutilizar, y los tiempos de aplicación específicos varían según los diferentes proyectos.
Si el CALB recuperado no se reutiliza continuamente y debe almacenarse después de la recuperación, debe lavarse, secarse y sellarse a 2-8 ℃.
Después de varias rondas de reutilización, si la eficiencia de la reacción se reduce ligeramente, se puede agregar CALB de manera adecuada y seguir usándose.Si la eficiencia de la reacción se reduce seriamente, debe reemplazarse.
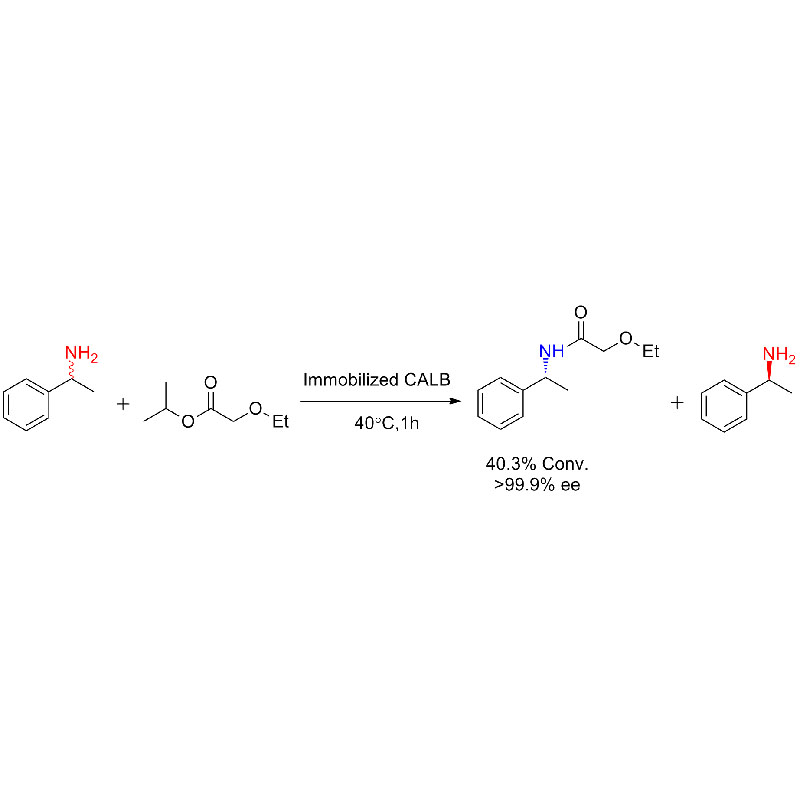
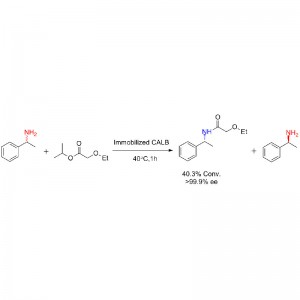
Ejemplo 1 (Aminólisis)(1):
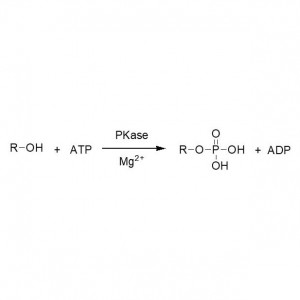
Ejemplo 2 (Aminólisis)(2):
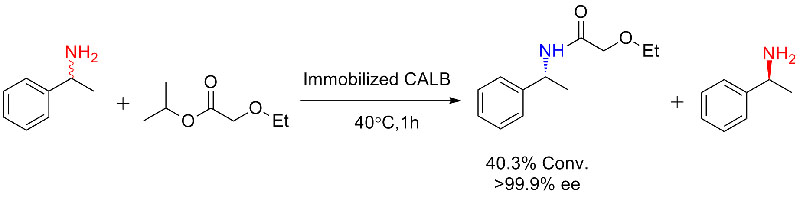
Ejemplo 3 (Síntesis de poliéster con apertura de anillo)(3):
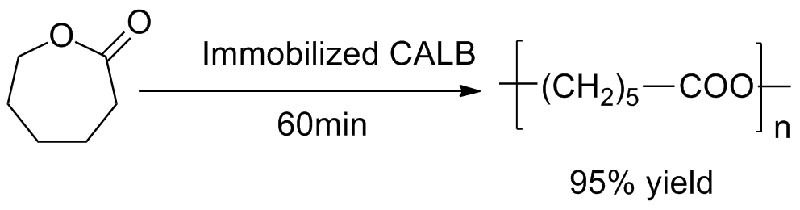
Ejemplo 4 (Transesterificación, regioselectiva del grupo hidroxilo)(4):
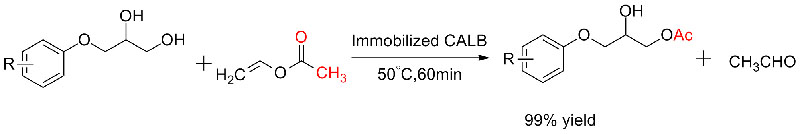
Ejemplo 5 (Transesterificación, resolución cinética de alcoholes racémicos)(5):
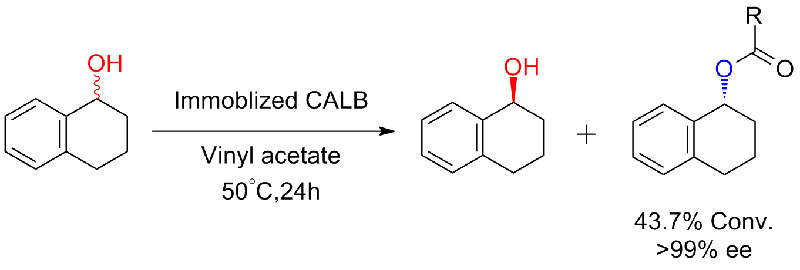
Ejemplo 6 (Esterificación, resolución cinética de ácido carboxílico)(6):
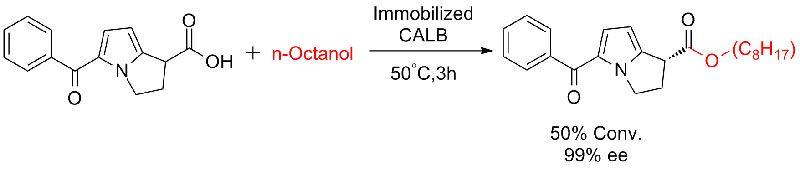
Ejemplo 7(Esterólisis, resolución cinética)(7):
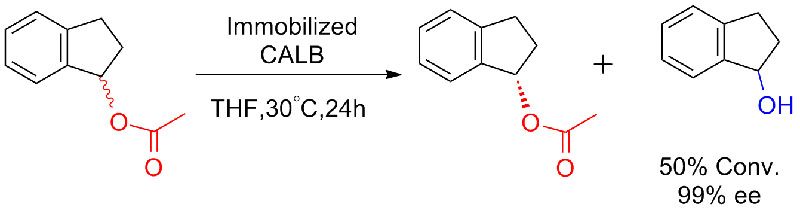
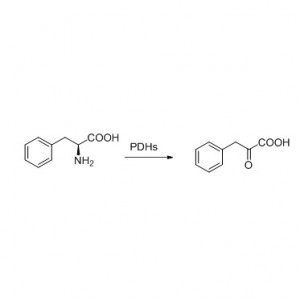
Ejemplo 8 (Hidrólisis de amidas)(8):
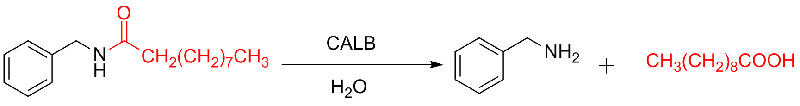
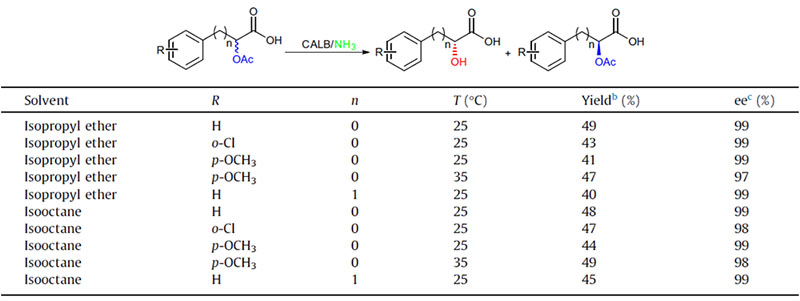
Ejemplo 9 (Acilación de aminas)(9):
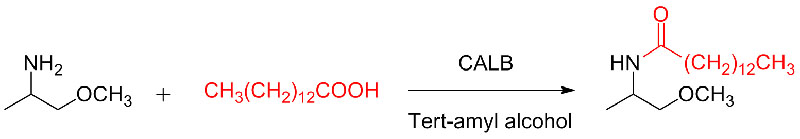

Ejemplo 10 (reacción de adición de Aza-Michael)(10):
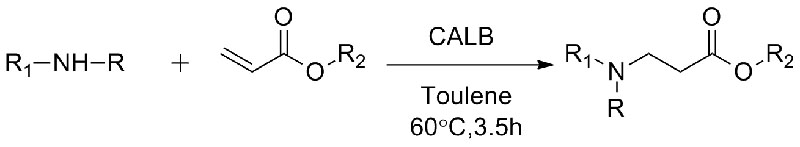
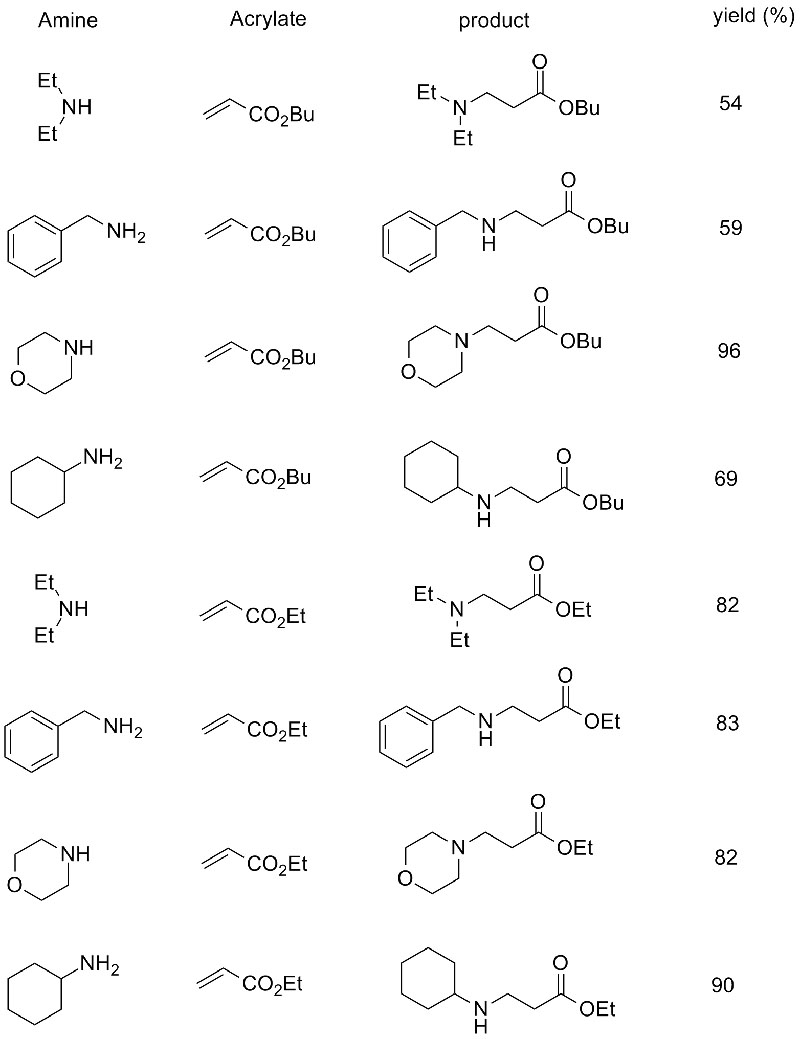
1. Chen S, Liu F, Zhang K, et al.Tetraedro Lett, 2016, 57: 5312-5314.
2. Olah M, Boros Z, anszky GH, et al.Tetraedro, 2016, 72: 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM, et al.Ind. Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ing. Ind.Química, 2015, 31: 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.Catal.B: Enzima, 2016, 132: 61-66.
6. Shinde SD, Yadav G D. Process Biochem, 2015, 50: 230-236.
7. Souza TC, Fonseca TS, Costa JA, et al.J. Mol.catal.B: Enzima, 2016, 130: 58-69.
8. Gavil´an AT, Castillo E, L´opez-Mungu´AJ Mol.catal.B: enzima, 2006, 41: 136-140.
9. Joubioux FL, Henda YB, Bridiau N, et al.J. Mol.catal.B: Enzima, 2013, 85-86: 193-199.
10. Dhake KP, Tambade PJ, Singhal RS, et al.Tetraedro Lett, 2010, 51: 4455-4458.